Iodate de sodium
| Iodate de sodium | |||
 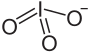 Structure de l'iodate de sodium. | |||
| Identification | |||
|---|---|---|---|
| No CAS | 7681-55-2 | ||
| No ECHA | 100.028.793 | ||
| No CE | 231-672-5 | ||
| SMILES | [O-]I(=O)=O.[Na+] PubChem, vue 3D | ||
| InChI | Std. InChI : vue 3D InChI=1S/HIO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 Std. InChIKey : WTCBONOLBHEDIL-UHFFFAOYSA-M | ||
| Apparence | cristaux blancs | ||
| Propriétés chimiques | |||
| Formule | INaO3NaIO3 | ||
| Masse molaire[1] | 197,892 4 ± 0,000 9 g/mol I 64,13 %, Na 11,62 %, O 24,25 %, | ||
| Propriétés physiques | |||
| T° fusion | 425 °C | ||
| Solubilité | 9,47 g·l-1 | ||
| Masse volumique | 4,28 g·cm-3 | ||
| Précautions | |||
| SGH[2] | |||
   Danger H272 : Peut aggraver un incendie ; comburant H302 : Nocif en cas d'ingestion H334 : Peut provoquer des symptômes allergiques ou d'asthme ou des difficultés respiratoires par inhalation P220 : Tenir/stocker à l’écart des vêtements/…/matières combustibles P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P311 : Appeler un CENTRE ANTIPOISON ou un médecin. P342 : En cas de symptômes respiratoires : | |||
| Transport[2] | |||
| |||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
L’iodate de sodium est un composé chimique de formule NaIO3. C'est un sel de l'acide iodique HIO3. C'est un agent oxydant et donc un comburant responsable d'incendies lorsqu'il est en contact avec des matériaux combustibles ou des agents réducteurs.
Préparation
L'iodate de sodium peut être obtenu en faisant réagir de l'acide iodique avec une base contenant du sodium :
- HIO3 + NaOH → NaIO3 + H2O.
On l'obtient également en ajoutant du diiode I2 à une solution chaude et concentrées d'hydroxyde de sodium NaOH ou d'un carbonate de sodium Na2CO3 :
Réactions
L'iodate de sodium peut être oxydé en periodate de sodium NaIO4 par des solutions aqueuses d'hypochlorite ClO− ou d'autres agents oxydants énergiques :
Notes et références
v · m | |
|---|---|
|
v · m | |
|---|---|
| Iodures I(-I) | |
| I(I) | |
| I(III) |
|
| I(V) |
|
| I(VII) |
|
 Portail de la chimie
Portail de la chimie











 Iodate_de_sodium
Iodate_de_sodium