Tioacetamida
 | ||
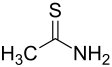 Estructura de la tioacetamida | ||
| Nombre IUPAC | ||
| Tioacetamida | ||
| General | ||
| Otros nombres | acetotioamida; TAA | |
| Fórmula estructural | 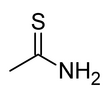 | |
| Fórmula molecular | CH 3C(S)NH 2 | |
| Identificadores | ||
| Número CAS | 62-55-5[1] | |
| Número RTECS | AC8925000 | |
| ChEBI | 32497 | |
| ChEMBL | CHEMBL38737 | |
| ChemSpider | 2006126 | |
| PubChem | 2723949 | |
| UNII | 075T165X8M | |
| KEGG | C19302 | |
| InChI InChI=InChI=1S/C2H5NS/c1-2(3)4/h1H3,(H2,3,4) Key: YUKQRDCYNOVPGJ-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Apariencia | Cristales blancos | |
| Olor | Ligeramente a azufre | |
| Densidad | 1319 kg/m³; 1,319 g/cm³ | |
| Masa molar | 75,13 g/mol | |
| Punto de fusión | 388 K (115 °C) | |
| Punto de ebullición | descompone | |
| Peligrosidad | ||
| SGA |  , ,  | |
| Frases H | H302, H315, H319, H350, H412 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
[editar datos en Wikidata] | ||
La tioacetamida es un compuesto organosulfurado con fórmula C2H5NS , del grupo de las tioamidas. En estado puro es un sólido cristalino blanco, soluble en agua y sirve como fuente de iones sulfuro en la síntesis de compuestos orgánicos e inorgánicos.
Investigación
Se sabe que la tioacetamida produce enfermedades hepáticas agudas o crónicas (fibrosis y cirrosis) en animales de experimentación. Su administración en ratas produce encefalopatía hepática, acidosis metabólica, aumento de los niveles de transaminasas, coagulación anormal y necrosis centrolobular, que son las principales características de enfermedades hepáticas crónicas, por lo que la tioacetamida permite experimentalmente replicar con precisión el inicio y la progresión de la enfermedad hepática humana con animales. [2]
Aplicaciones en química
La tioacetamida se utiliza ampliamente en el análisis inorgánico cualitativo clásico como fuente in situ de iones sulfuro, ya que por hidrólisis produce acetamida, a la vez que libera iones sulfuro capaces de reaccionar con numerosos iones metálicos, mucho de ellos insolubles en medio acuoso.
- (M = Ni, Pb, Cd, Hg)
Esta reactividad también se da con algunos cationes trivalentes (As3+, Sb3+, Bi3+ ) y en algunos monovalentes (Ag+, Cu+ ).
Preparación
La tioacetamida se prepara tratando acetamida con pentasulfuro de fósforo como se muestra en la siguiente reacción: [3]
Estructura
La molécula presenta plano de simetría. Las distancias CS, CN y CC son 1,68, 1,31 y 1,50 Å, respectivamente. Las distancias cortas CS y CN indican enlaces múltiples, [4] lo que implicaría un equilibrio resonante entre la forma amida y la forma enólica:
Seguridad
La tioacetamida es un carcinógeno de clase 2B.
Se sabe que produce hepatotoxicidad marcada en animales expuestos. Los valores de toxicidad son 301 mg/kg en ratas (LD50, administración oral), 300 mg/kg en ratones (LD50, administración intraperitoneal). [5] Esto se evidencia por cambios enzimáticos, que incluyen elevación de los niveles séricos de alanina transaminasa, aspartato transaminasa y ácido aspártico . [6]
Referencias
- ↑ Número CAS
- ↑ Dwivedi DK, Jena GB (2018). «Glibenclamide protects against thioacetamide-induced hepatic damage in Wistar rat: investigation on NLRP3, MMP-2, and stellate cell activation». Naunyn-Schmiedeberg's Archives of Pharmacology 391 (11): 1257-1274. PMID 30066023. doi:10.1007/s00210-018-1540-2.
- ↑ Schwarz, G. (1945). "2,4-Dimethylthiazole". Org. Synth. 25: 35; Coll. Vol. 3: 332.
- ↑ Trevor W. Hambley; David E. Hibbs; Peter Turner; Siân. T. Howard; Michael B. Hursthouse (2002). «Insights into Bonding and Hydrogen Bond Directionality in Thioacetamide from the Experimental Charge Distribution». J. Chem. Soc., Perkin Trans. (2): 235-239. doi:10.1039/B109353C.
- ↑ «HSDB: THIOACETAMIDE CASRN: 62-55-5». Hazardous Substances Data Bank.
- ↑ Ali, S.; Ansari, K. A.; Jafry, M. A.; Kabeer, H.; Diwakar, G. (2000). «Nardostachys jatamansi protects against liver damage induced by thioacetamide in rats». Journal of Ethnopharmacology 71 (3): 359-363. PMID 10940571. doi:10.1016/S0378-8741(99)00153-1.
- «Thioacetamide (Sulfo amine)». Chemical Land 21. Consultado el 14 de febrero de 2006.
 Datos: Q416253
Datos: Q416253 Multimedia: Thioacetamide / Q416253
Multimedia: Thioacetamide / Q416253














