Expansión de anillo de Dowd-Beckwith
La expansión de anillo de Dowd-Beckwith es un método de síntesis orgánica en la que un β-cetoéster cíclico se expande hasta 4 carbonos en una reacción de radicales libres a través de un sustituyente α-haloalquilo. El sistema iniciador de radicales se basa en AIBN e hidruro de tributilestaño. El β-cetoéster cíclico se puede obtener mediante una ciclización de Dieckmann. La reacción original consistió en una sustitución nucleofílica alifática del enolato del 2-oxociclohexano-1-carboxilato de etilo con 1,4-diyodobutano e hidruro de sodio seguida de una expansión del anillo a 6-oxociclodecano-1-carboxilato de etilo. Una reacción secundaria es la reducción orgánica del yodoalcano.

Mecanismo de reacción
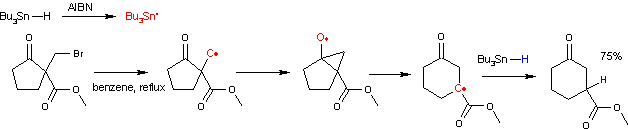
El mecanismo de reacción involucra un intermedio bicíclico. La reacción se inicia por descomposición térmica de AIBN. Los radicales resultantes extraen hidrógeno del hidruro de tributilestaño a un radical tributilestaño que a su vez extrae el átomo de halógeno para formar un radical alquilo. Este radical ataca al grupo carbonilo a un cetilo bicíclico intermedio. Este intermedio luego se transpone con la expansión del anillo en una nueva especie de radical de carbono que se recombina con un radical protón del hidruro de tributilestaño que propaga el ciclo catalítico.
Alcance

Una reacción secundaria que acompaña a esta expansión del anillo es la reducción orgánica del haloalcano a un grupo alquilo saturado. Un estudio muestra que el éxito depende fundamentalmente de la accesibilidad del grupo carbonilo. Los experimentos con deuterio también muestran la presencia de un intercambio de hidruro 1,5. La reacción del radical alquilo con el grupo éster carbonilo también es posible pero tiene una energía de activación desfavorable.
Referencias
- ^ A new tributyltin hydride-based rearrangement of bromomethyl .beta.-keto esters. A synthetically useful ring expansion to .gamma.-keto esters Paul Dowd, Soo Chang Choi; J. Am. Chem. Soc.; 1987; 109(11); 3493–3494. Abstract
- ^ Free radical ring expansion by three and four carbons Paul Dowd, Soo Chang Choi; J. Am. Chem. Soc.; 1987; 109(21); 6548–6549. Abstract
- ^ Rearrangement of suitably constituted aryl, alkyl, or vinyl radicals by acyl or cyano group migration Athelstan L. J. Beckwith, D. M. O'Shea, Steven W. Westwood; J. Am. Chem. Soc.; 1988; 110(8); 2565–2575. Abstract
- ^ Three-Carbon Dowd–Beckwith Ring Expansion Reaction versus Intramolecular 1,5-Hydrogen Transfer Reaction: A Theoretical Study Diego Ardura and Tomás L. Sordo J. Org. Chem.; 2005; 70(23) pp 9417 – 9423; (Article) doi 10.1021/jo051551g AbstractUso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
 Datos: Q5302672
Datos: Q5302672 Multimedia: Dowd-Beckwith ring-expansion reaction / Q5302672
Multimedia: Dowd-Beckwith ring-expansion reaction / Q5302672











